ПРИМЕНЕНИЕ ЦИТИКОЛИНА (Роноцит) В КОМПЛЕКСНОМ ЛЕЧЕНИИ БОЛЬНЫХ ПЕРВИЧНОЙ ОТКРЫТОУГОЛЬНОЙ ГЛАУКОМОЙ
Янгиева Н.Р., Туйчибаева Д.М., Абасханова Н.Х. Ташкентская медицинская академия, кафедра глазных болезней Узбекистан, г.Ташкент
Актуальность. Термин «глаукома» объединяет большую группу заболеваний глаз различного генеза с проградиентным, хроническим течением. Как правило, глаукома протекает с повышением уровня внутриглазного давления (ВГД); за исключением глаукомы с так называемым, низким (псевдонормальным) давлением, развитием оптической нейропатии, проявляющейся характерными изменениями ретинальных волокон сетчатки головки зрительного нерва и прогрессирующим ухудшением зрительных функций с возникновением типичных дефектов поля зрения [1,3].
Первичная открытоугольная глаукома (ПОУГ) – хроническое заболевание, поражающее работоспособное население и более старшие возрастные группы, которая лидирует по числу случаев среди всех видов глаукомы и достигает 80% от общего числа больных [2].
Ежегодно, вновь заболевает глаукомой 1 из 1000 человек в возрастной группе от 40 до 45 лет [6]. В настоящее время, во всем мире насчитывается около 67–70 млн. человек, теряющих зрение от глаукомы, и каждый десятый из них уже ослеп.
В патогенезе развития глаукоматозного поражения выделяют основные этапы развития:
- нарушение и ухудшение оттока водянистой влаги из полости глазного яблока;
- повышение ВГД выше уровня, толерантного для данного глаза;
- ухудшение кровообращения в тканях глаза;
- гипоксия и ишемия в области выхода зрительного нерва и, как результат, активация перекисного окисления липидов;
- активация микроглии и синтез чрезвычайно агрессивных субстанций, таких как свободные радикалы (супероксид анион, оксид азота) и глютамата, которые оказывают повреждающее действие на нервную ткань;
- компрессия нервных волокон в зоне их выхода из глазного яблока, что приводит к нарушению их функции и гибели;
- дистрофия и атрофия зрительных волокон, распад их материнских ганглиозных клеток сетчатки;
- развитие глаукомной оптической атрофии и последующей атрофии зрительного нерва [5,6].
В зависимости от развитости глаукоматозного процесса часть нервных волокон зрительного нерва атрофируется, а часть находится в состоянии парабиоза, что позволяет считать возможным восстановление их функции под влиянием лечения (медикаментозного или хирургического) [5,6].
В настоящее время медикаментозное лечение глаукомы проводится по трем основным направлениям:
– терапия, направленная на снижение ВГД;
– терапия, способствующая улучшению кровоснабжения внутренних оболочек глаза и внутриглазной части зрительного нерва;
– терапия, направленная на нормализацию обменных процессов (метаболизма) в тканях глаза с целью воздействия на дистрофичесие процессы, характерные для глаукомы (нейропротективная терапия) [4,8].
Как справедливо отмечал T. Yamamoto еще в 2001 г., нейропротективная терапия глаукомы в ближайшее время станет основополагающей в лечении этого тяжелого заболевания [7].
Суть нейропротективного лечения заключается в предотвращении каскада реакций, вызывающих поражение нейронов, главным образом вследствие ишемии. Следует подчеркнуть, что речь идет именно о последовательно развивающихся реакциях, когда в патологический процесс вовлекаются все новые и новые нейроны, а окружающие их пораженные ткани сами становятся источником патологических явлений. В этой связи нейропротективное лечение должно осуществляться в рамках так называемого терапевтического окна, когда поражение нервной ткани еще не стало необратимым [7].
В ряде работ зарубежных учёных показана эффективность применения препарата «Цитиколин» (CDP — choline) в отношении восстановления зрительных функций у больных с первичной открытоугольной глаукомой [9, 12, 14]. Цитиколин (Роноцит) — препарат, улучшающий метаболизм головного мозга, ноотропное средство. Являясь предшественником ключевых ультраструктурных компонентов клеточной мембраны (преимущественно фосфолипидов), способствует восстановлению поврежденных мембран клеток, ингибирует действие фосфолипаз, препятствуя избыточному образованию свободных радикалов, а также, предотвращая гибель клеток, воздействует на механизмы апоптоза и улучшает передачу нервных импульсов в холинергических нейронах [10,11,13].
Учитывая патогенетическую обоснованность, целью нашей работы явилось изучение нейропротекторного действия препарата Роноцит у больных ПОУГ с нормализованным ВГД на основании клинико-функциональных показателей органа зрения.
Материалы и методы:
Нами обследовано 60 пациентов ( 38 женщин и 22 мужчин), средний возраст которых составил 60,75±12,83 года, с установленным диагнозом первичная открытоугольная глаукома (ПОУГ) I, II и III стадии. Длительность заболевания у больных составляла от 6 месяцев до 10 лет, в среднем 3,1 ± 0,6 года.
Условием включения пациентов в исследование было достижение целевого ВГД как медикаментозным, так и хирургическим путем и не применение нейропротекторного лечение в течение 6 месяцев.
Критериями исключения послужили:
- выраженное помутнение хрусталика, выраженная макулярная дегенерация, сосудистые заболевания сетчатки и зрительного нерва, диабетическая ретинопатия;
- высокая степень аномалий рефракции;
- тяжелая соматическая патология;
- некомпенсированный офтальмотонус.
Все больные были распределены на 2 группы — основную и контрольную. Обе группы больных по основным клиническим показателям были репрезентативны.
Контрольную группу составили 28 больных (47 глаз), которые получали общепринятую традиционную терапию: 1% раствор эмоксипина в дозе 1,0 мл парабульбарно; 10% раствор пирацетама в дозе 5,0 мл внутривенно; 1% раствор рибофлавина мононуклеотида в дозе 1,0 мл, 5% раствор пиридоксина гидрохлорида в дозе 1,0 мл, 5% раствор аскорбиновой кислоты в дозе 2,0 мл - внутримышечно в течении 10 дней; внутрь кавинтон по 1таблетке 3раза в день, аевит по 1 таблетке 3 раза в день в течение 1 месяца.
Основную группу составили 32 больных (58 глаз), получавшие традиционную терапию и Роноцит (Ротафарм, Великобритания), который вводили внутривенно на изотоническом растворе в течение 10 дней, в дозе 1000 мг/сут.
Распределение больных по стадиям глаукомы в каждой группе представлено в табл. 1.
Таблица 1. Распределение больных по стадиям глаукомы по группам исследования
|
Стадии ПОУГ |
Контрольная группа, n=28 (47 глаз – 100%) |
Основная группа, n=32 (54 глаза – 100%) |
|
I |
8 (14 глаз – 29,8%) |
10 (16 глаз – 29,6%) |
|
II |
11 (18 глаз – 38,3%) |
11 (19 глаз – 35,2%) |
|
III |
9 (15 глаз – 31,9%) |
11 ( 19 глаз – 35,2%) |
Как видно из табл. 1, в контрольной группе исследования I стадию заболевания имели 8 человек (14 глаз), II стадию - 11 человек (18 глаз), III стадию - 9 человек (15 глаз), что составило 29,8, 38,3 и 31,9% соответственно от числа исследованных глаз пациентов 1-й группы. В основной группе исследования I стадию имели 10 человек (16 глаз), II стадию - 11 человек (19 глаз), III стадию - 11 человек (19 глаз),что составило 29.6, 35,2 и 35,2 % соответственно от числа исследованных глаз пациентов 2-й группы.
Таким образом, число пациентов, имеющих I, II и III стадию ПОУГ, в каждой группе исследования сопоставимо.
Всем больным проводили: визометрию с наилучшей коррекцией, биомикроскопию, гониоскопию, компьютерную периметрию на анализаторе поля зрения Humphrey (HFA II 740), тонографию, осмотр глазного дна с линзой VOLK, оптическую когерентную томографию (ОКТ), определяли порог электрической чувствительности и лабильность зрительного нерва по фосфену, отслеживали приверженность пациентов к лечению. Уточнялось наличие побочных явлений, соблюдение пациентом режима инстилляций, изменения в самооценке пациентом своего состояния и настроения.
Клиническую эффективность лечения оценивали по показателям: остроты зрения (ОЗ), среднему отклонению светочувствительности сетчатки в центральной зоне, порогу электрической чувствительности по фосфену (ПЭЧФ), критической частоты исчезновения мелькающих фосфенов (КЧИМФ) в режиме «3,0».
Результаты и обсуждение. На всех этапах исследования отмечалась хорошая местная и системная переносимость препарата Роноцит.
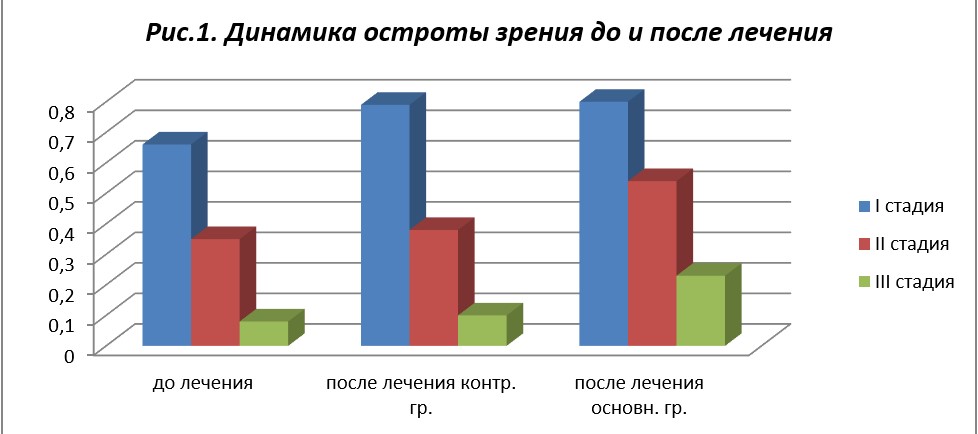
Динамика остроты зрения до и после лечения представлена в табл. 2 и на рис. 1.
Таблица 2. Динамика остроты зрения до и после лечения
|
Стадии ПОУГ |
Контрольная группа, n=28 (47 глаз – 100%) |
Основная группа, n=32 (54 глаза – 100%) |
||
|
До лечения |
После лечения |
До лечения |
После лечения |
|
|
I |
0,73±0,01 |
0,79±0,02 p<0,05 |
0,66±0,01 |
0,80±0,02 p<0,001 |
|
II |
0,37±0,03 |
0,38±0,02 p>0,05 |
0,35±0,03 |
0,54±0,02 p<0,001 |
|
III |
0,09±0,04 |
0,10±0,02 p>0,05 |
0,08±0,04 |
0,23±0,04 p<0,001 |
Примечание: p – достоверность различия показателя в сравнении со значением его до лечения при той же стадии ПОУГ
Примечание: p – достоверность различия показателя в сравнении со значением его до лечения при той же стадии ПОУГ
Как видно из табл. 2 и рис. 1, ОЗ у больных основной группы после лечения достоверно улучшилась и составила 0,80 ± 0,02 при I стадии заболевания, 0,54 ± 0,02 — при II и 0,23 при III стадии (при исходных показателях 0,66 ± 0,01; 0,35 ± 0,03 и 0,08±0,04 соответственно). ОЗ у больных контрольной группы при I стадии заболевания составила 0,79 ± 0,02, при II стадии ПОУГ в этой же группе — 0,38 ± 0,02 и при III стадии - 0,10±0,02 (при исходных показателях 0,73 ± 0,01; 0,37 ± 0,03 и 0,09±0,04 соответственно), то есть отмечается некоторое улучшение зрения, но показатели недостоверны (р > 0,05).
Таким образом, при лечении больных с ПОУГ препаратами по разработанной нами схеме ОЗ достоверно улучшилась на 0,08–0,2, что более чем в 4 раза выше, чем при традиционной терапии, что, по нашему мнению, связано с правильно подобранной комбинацией препаратов в зависимости от длительности терапевтического воздействия и их синергизма. Известно, что ОЗ при ПОУГ не является объективным показателем течения ГОН, но тем не менее существенно влияет на качество жизни пациента.
Функции внутренних слоев сетчатки и аксиального пучка зрительного нерва оценивали методом определения ПЭЧФ и электрической лабильности по фосфену (КЧИМФ) у исследованных больных с ПОУГ.
Изменение порога электрической чувствительности по фосфену (мкА) у исследованных больных с ПОУГ представлено в табл. 3 и на рис. 2.
Таблица 3. Изменение порога электрической чувствительности по фосфену, мкА
|
Стадии ПОУГ |
Контрольная группа, n=28 (47 глаз – 100%) |
Основная группа, n=32 (54 глаза – 100%) |
||
|
До лечения |
После лечения |
До лечения |
После лечения |
|
|
I |
130,0±7,0 |
120,1±6,5 p<0,001 |
138,8±9,3 |
107,3±6,4 p<0,001 |
|
II |
177,4±11,3 |
157,9±11,6 p>0,05 |
170,8±13,0 |
135,4±10,9 p<0,001 |
|
III |
208,7±16,5 |
198,5±16,8 p>0,05 |
210,7±17,2 |
175,6±12,8 p<0,001 |
Примечание: p – достоверность различия показателя в сравнении со значением его до лечения при той же стадии ПОУГ
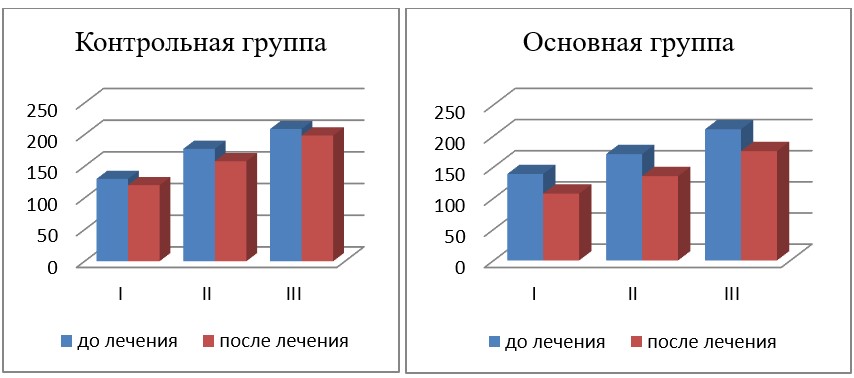
Рис.3. Изменение порога электрической чувствительности по фосфену, мкА
Примечание: p – достоверность различия показателя в сравнении со значением его до лечения при той же стадии ПОУГ
Как видно из табл. 3 и рис. 2, в основной группе больных при I стадии ПОУГ порог электрической чувствительности по фосфену до лечения был равен 138,8 ± 9,3 мкА, после лечения показатель достоверно (р < 0,001) снизился (на 22,7 %) и составлял 107,3 ± 6,4 мкА по сравнению с показателем до лечения при той же стадии заболевания, принятому за 100 %; при II стадии ПОУГ показатель до лечения был равен 170,8 ± 13,0 мкА, а после лечения достоверно (р < 0,001) снизился (на 20,7 %) до 135,4 ± 10,9 мкА по сравнению с показателем до лечения при той же стадии заболевания, принятым за 100 %. При III стадии ПОУГ показатель до лечения был равен 210,7±17,2 мкА, а после лечения достоверно снизился (на 17,0%) до 175,6±12,8 мкА по сравнению с показателем до лечения при той же стадии заболевания.
В контрольной группе исследования при I стадии ПОУГ показатель ПЭЧФ до лечения был равен 130,0 ± 7,0 мкА, после лечения показатель достоверно (р < 0,001) снизился (на 7,6 %) по сравнению с показателем до лечения при той же стадии заболевания, принятым за 100 %, и составил 120,1 ± 6,5 мкА; при II стадии ПОУГ показатель до лечения был равен 177,4 ± 11,3 мкА, а после лечения снизился незначительно (р > 0,05) — до 157,9 ± 11,6 мкА, что на 10,9 % меньше по сравнению с показателем до лечения при той же стадии заболевания, принятым за 100 %; при III стадии ПОУГ показатель до лечения был равен 208,7±16,5 мкА, а после лечения снизился незначительно (р > 0,05) — до 198,5±16,8 мкА, что на 4,9 % меньше по сравнению с показателем до лечения при той же стадии заболевания.
Было установлено, что если первым назначенным препаратом у пациента были капли из группы аналогов простагландинов, показатель ПЭЧФ всегда был ниже, чем у других, что, очевидно, связано с более быстрым достижением целевого давления и сохранением электрической чувствительности нервных волокон, а также с нейропротекторным действием самого препарата. Более высокая эффективность по ПЭЧФ была установлена нами у пациентов основной группы с меньшим стажем ПОУГ, которым назначалась комбинированная терапия в комплексном лечении.
Результаты исследования показателя КЧИМФ у исследованных больных с ПОУГ представлены в табл. 4 и на рис. 3.
Таблица 4. Изменение КЧИМФ у больнқх ПОУГ
|
Стадии ПОУГ |
Контрольная группа, n=28 (47 глаз – 100%) |
Основная группа, n=32 (54 глаза – 100%) |
||
|
До лечения |
После лечения |
До лечения |
После лечения |
|
|
I |
36,4±1,3 |
37,4±1,3 p>0,05 |
33,8±1,5 |
38,70±0,87 p<0,001 |
|
II |
28,7±0,87 |
29,4±0,8 p>0,05 |
27,3±0,76 |
31,1±0,5 p<0,001 |
|
III |
21,1±16,5 |
21,9±0,38 p>0,05 |
20,7±0,28 |
24,6±0,42 p<0,001 |
Примечание: p – достоверность различия показателя в сравнении со значением его до лечения при той же стадии ПОУГ
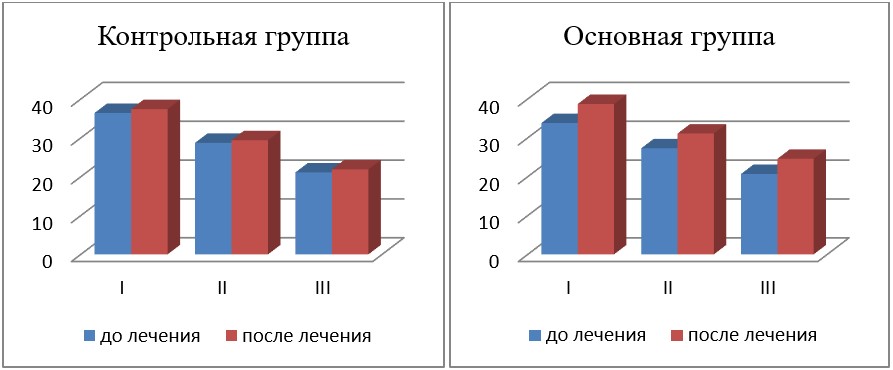
Рис.3. Изменение КЧИМФ у больнқх ПОУГ
Примечание: p – достоверность различия показателя в сравнении со значением его до лечения при той же стадии ПОУГ
Как видно из табл. 4 и рис. 3, у больных с ПОУГ в основной группе отмечалось достоверное повышение показателя КЧИМФ в среднем на 14,5 % (до лечения — 33,8 ± 1,5, после лечения — 38,70 ± 0,87) при I стадии и на 13,9 % — при II стадии (до лечения — 27,30 ± 0,76, после лечения — 31,1 ± 0,5), в то время как в контрольной группе — на 2,7 и 2,4 % соответственно по сравнению с показателем до лечения при той же стадии заболевания, принятым за 100 %, что достоверно ниже, чем у больных 1-й группы при лечении рекомендуемой нами терапией. Это свидетельствует о достоверно большей активации ганглиозных клеток сетчатки и их аксонов у пациентов основной группы.
Таким образом, применение препарата Роноцит в комплексном лечении пациентов с ПОУГ, позволяет в большей степени активизировать зрительный анализатор.
Результаты исследования пороговой чувствительности сетчатки (dB) по данным компьютерной статической периметрии Humphrey представлены в табл. 5 и на рис. 4.
Таблица 5. Динамика пороговой чувствительности сетчатки (dB)
|
Стадии ПОУГ |
Контрольная группа, n=28 (47 глаз – 100%) |
Основная группа, n=32 (54 глаза – 100%) |
||
|
До лечения |
После лечения |
До лечения |
После лечения |
|
|
I |
-4,6±0,1 |
-4,40±0,09 p>0,05 |
-4,5±0,08 |
-3,5±0,07 p<0,001 |
|
II |
-7,0±0,13 |
-6,8±1,4 p>0,05 |
-7,20±0,08 |
-6,10±0,09 p<0,001 |
|
III |
-11,5±0,09 |
-11,3±0,08 p>0,05 |
11,7±0,09 |
-10,6±0,08 p<0,001 |
Примечание: p – достоверность различия показателя в сравнении со значением его до лечения при той же стадии ПОУГ

Рис.4. Изменение пороговой чувствительности сетчатки по данным компьютерной статической периметрии Humphrey
Примечание: p – достоверность различия показателя в сравнении со значением его до лечения при той же стадии ПОУГ
Как видно из табл. 5 и рис. 4, в основной группе больных при I стадии ПОУГ пороговая чувствительность сетчатки до лечения была равна –4,50 ± 0,08 dB, после лечения показатель достоверно (р < 0,001) повысился (на 22,2 %) и составил –3,50 ± 0,07 dB; при II стадии ПОУГ показатель до лечения был равен –7,20 ± 0,08 dB, а после лечения достоверно (р < 0,001) повысился (на 15,3 %) до –6,10 ± 0,09 dB по сравнению с показателем до лечения при той же стадии заболевания, принятым за 100 %; при III стадии ПОУГ показатель до лечения был равен –11,7 ± 0,09 dB, а после лечения достоверно (р < 0,001) повысился (на 9,4%) до –10,6± 0,08 dB по сравнению с показателем до лечения при той же стадии заболевания
Во 2-й группе исследования (табл. 5, рис. 4) при I стадии ПОУГ пороговая чувствительность сетчатки до лечения была равна –4,6 ± 0,1 dB, после лечения показатель достоверно (р < 0,05) повысился (на 4,3 %) и составил –4,40 ± 0,09 dB; при II стадии ПОУГ показатель до лечения был равен –7,00 ± 0,13 dB, а после лечения повысился (р > 0,05) до –6,8 ± 1,4 dB, что на 2,9 % больше по сравнению с показателем до лечения при той же стадии заболевания, принятым за 100 %; при III стадии ПОУГ показатель до лечения был равен –11.5 ± 0,13 dB, а после лечения повысился (р > 0,05) до –11.3 ± 0,08 dB, что на 1,7 % больше по сравнению с показателем до лечения при той же стадии заболевания
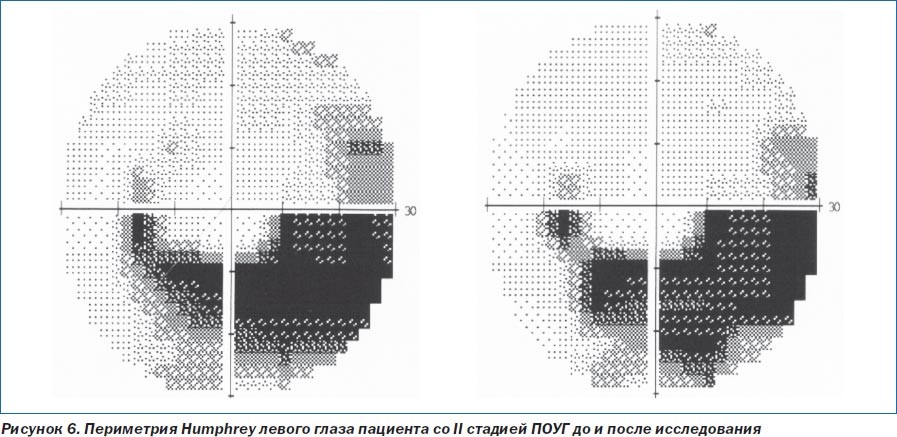
По данным компьютерной статической периметрии Humphrey, отмечено увеличение светочувствительности сетчатки, уменьшение количества, площади и глубины скотом, расширение площади с нормальной светочувствительностью у больных основной группы (рис. 5).
Таким образом, Роноцит (цитиколин) оказывает выраженное нейропротекторное действие при ПОУГ, осуществляя эффективную защиту нервной ткани и замедляя апоптоз. Помимо улучшения клинико-функциональных показателей органа зрения нами было отмечено улучшение общего самочувствия, внимания и общей работоспособности у всех пациентов.
Выводы:
- Анализ полученных результатов свидетельствует о достаточно высокой клинической эффективности препарата Роноцит(цитиколин) при консервативном лечении больных ПОУГ с компенсированным ВГД.
- Данный препарат может быть рекомендован в качестве фоновой нейропротективной терапии.
Литература
- Куроедов А.В., Городничий В.В. Компьютерная ретинотомография (HRT): диагностика, динамика, достоверость. М., 2007.
- Алексеев В.Н., Мартынова Е.Б. Новые подходы к гипотензивной терапии первичной открытоугольной глаукомы // Cons/ Medicum (прил).– 2001. –С. 3–9.
- Волков В.В. Глаукома отрытоугольная. М.: МИА, 2008.
- Егоров Е.А., Алексеев В.Н. и др. Рациональная терапия в офтальмологии. М.: Изд–во «Литтера», 2006.
- Нестеров А.П. Глаукома. М.: МИА, 2008.
- Шкарлова С.И. Глаукома и катаракта. Серия «Медицина для вас». Ростов н/Д: Феникс, 2001. 192 с.
- Курышева Н.И. Глаукомная оптическая нейропатия М.: МЕДпресс–информ, 2006.
- Курышева Н.И. Роль методов визуализации диска зрительного нерва и слоя нервных волокон сетчатки в ранней диагностике глаукомы // Глаукома. – 2007. - № 1. – С.16 – 22.
- Cohen J. D., Drury J. H., Ostdiek J. et al. // Am. Heart J. 2000. Vol. 139. P. 734–738.
- Han Y.S., Chung I.Y., Park J.M. et al. Neuroprotective effect of citicoline on retinal cell damage induced by kainic acid in rats // Ophthalmol. 2005. Vol. 19. P. 219–226.
- Kaushik S., Pandav S.S., Ram J. Neuroprotection in glaucoma// J. Postgrad. Med. 2003 Jan–Mar. 49 (1): 90–95.
- Neufeld A. // International Glaucoma Review. 2005. Vol. 7. P. 21.
- Haefliger I., Fleischhauer J., Flammer J. // Eye. 2000. Vol. 14. P. 464–472.
- Schmetterer L.// Abstracts of 7th ISOPT. Budapest, Hungary. 2008. P. 35.
- Secades J.J., Lorenzo J.L. Citicoline: pharmacological and clinical review // Methods Find Exp Clin Pharmacol. 2006. Vol. 28. P. 1–56.


